Slik kan KI gi mer presise diagnoser og raskere utvikling av legemidler
KRONIKK: Fremskritt innen kunstig intelligens har enormt potensial til å forbedre menneskers liv gjennom nye medisinske metoder. Faktisk er de allerede blitt en integrert del av medisinsk forskning og praksis.

Forskersonen er forskning.nos side for debatt og forskernes egne tekster. Meninger i tekstene gir uttrykk for skribentenes holdninger. Hvis du ønsker å delta i debatten, kan du lese hvordan her.
Radiologiske
bilder er helt sentrale i diagnostikk og behandlingsplanlegging av
hjernesvulster og andre sykdommer. Imidlertid er disse bildene svært komplekse.
En MR-undersøkelse består ikke bare av én bildeserie, men forskjellige bildeserier
som uttrykker ulike sider av vevenes egenskaper.
Man kan faktisk sammenligne en MR-undersøkelse med et symfoniorkester hvor hvert instrument tilsvarer én bildeserie: du behøver mange ulike bildeserier for å få frem ulike aspekter – tilsvarende den nyanserte klangen i symfonien. Samtidig krever det mye tid og erfaring å kunne tolke slike MR-bilder.
Ettersom få leger har evne til å forholde seg til alle pasientens MR-serier samtidig, må man nøye se gjennom dem én og én. Det å lytte til en symfoni ett instrument om gangen er mulig – men kanskje ikke optimalt.
Dette er så banebrytende at Demis Hassabis og John M. Jumper fikk nobelprisen i kjemi for det.
KI-modeller basert på nevrale nettverk har derimot en matematisk tilnærming til bildematerialet og kan sammenstille informasjon og mønstre fra alle de ulike bildeseriene i én analyse. Det er nettopp teknologien bak dette John Hopfield nå fikk nobelprisen i fysikk for.
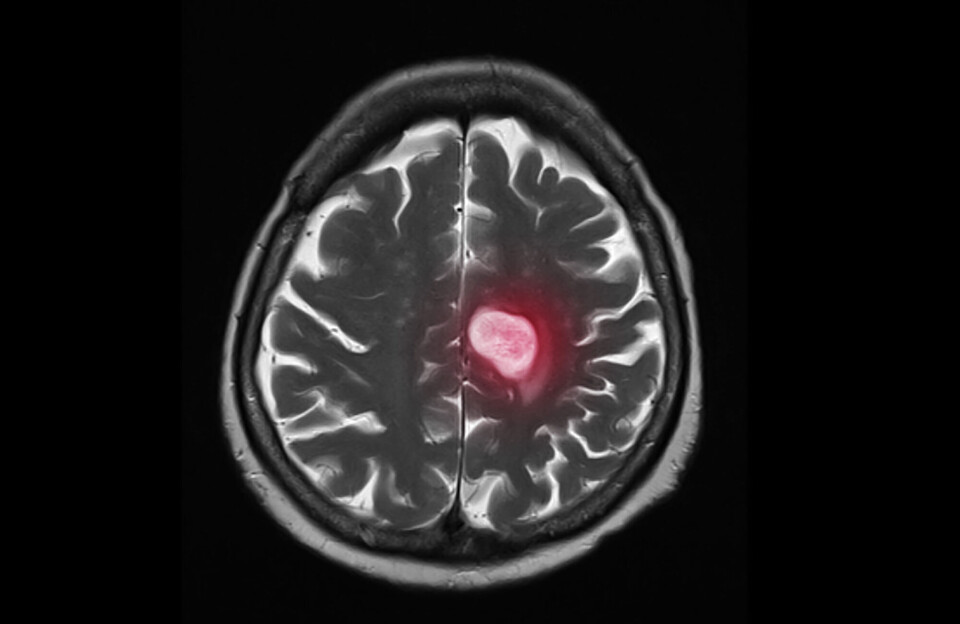
Inntegning av kreftsvulster
Et konkret eksempel på når slik teknologi kan være til hjelp er ved inntegning av hjernesvulster for stråleterapi. Optimal strålebehandling fordrer helt presis inntegning slik at alt tumorvev og minst mulig friskt vev kommer med i strålefeltet. Dette er imidlertid en omstendelig prosess, og ekspertisen til den enkelte lege vil spille inn på sluttresultatet.
Trente KI-modeller kan automatisk gjenkjenne ulike deler av svulsten og markere dem på bildene. På denne måten kan legen få et bedre grunnlag for å vurdere bildematerialets medisinske betydning, og samtidig spare tid.
Å se «hele bildet»
René Magrittes ikoniske maleri «The Treachery of Images» advarer oss om faren ved å forveksle bilder med virkelighet. «Dette er ikke en pipe», står det under bildet av en pipe. Banalt men sant - og faktisk også gyldig innen radiologi. MR-bilder viser representasjoner av kroppen, men det du ser er ikke kroppen.

Gråtonene representerer snarere karakteristikkene til kroppens ulike vev. Ved utredning av hjernesvulster må det radiologiske bildematerialet sammenholdes med annen medisinsk informasjon. Kliniske faktorer samt demografiske- og genetiske variabler er faktorer som legges til grunn for diagnose og behandling.
Men det finnes fortsatt kunnskapshull rundt hvordan, og i hvilken grad, de ulike faktorene påvirker hverandre. Også her kan den prisvinnende teknologien anvendes til å finne mønstre fra gode - og mindre gode - erfaringer fra tidligere pasienter i lys av disse variablene. Det betyr at man kan sette tidligere erfaringer i system på en slik måte at det peker ut den mest optimale behandlingen for nye, lignende, pasienter.
Utvikling av nye legemidler og syntetiske proteiner
Når sykdom oppstår er det ofte på grunn av mutasjoner i gener. Gener inneholder «oppskriften» for proteiner, og mutasjoner kan resultere i at viktige proteiner formes feil. Da kan celler begynne å vokse ukontrollert, som ved kreft, eller prosesser forstyrres, som ved Alzheimers.
Kunnskap om proteinets struktur er avgjørende for å forstå sykdommen. Det er også strukturen som forutsetter hvordan legemiddelet må utformes for å virke, omtrent slik et støpsel utformes til stikkontakten. Proteinene er imidlertid så små at de ikke kan sees i et mikroskop, noe som gjør kartleggingen utfordrende.
Selv om de nye teknologiene er lovende vet vi selvsagt at det finnes en rekke fallgruver og begrensninger knyttet til bruk av KI
AlphaFold er en åpen KI-løsning som bruker informasjon fra store databaser med allerede kartlagte proteinstrukturer til å forutsi nye strukturer. Proteinenes sannsynlige 3D-struktur kalkuleres ut fra rekkefølgen på aminosyrene og aminosyrenes biokjemiske egenskaper. Dette er så banebrytende at Demis Hassabis og John M. Jumper fikk nobelprisen i kjemi for det.
Slik teknologi kan også brukes til å designe helt nye proteiner med spesifikke egenskaper for legevitenskapelige formål, såkalte syntetiske proteiner. Forskningen på syntetiske proteiner er særlig potent innen kreftbehandling og virusbekjempelse. Det er også ventet at lignende KI-modeller i fremtiden kan brukes til å øke vår forståelse rundt mer komplekse biomolekyler.
Så da er det bare å implementere?
Selv om de nye teknologiene er lovende vet vi selvsagt at det finnes en rekke fallgruver og begrensninger knyttet til bruk av KI. En av de mest betydelige utfordringene er risikoen for at KI-modeller – lik mennesker – kan basere sine analyser på skjevheter i treningsdataene. Altså at ikke alle kombinasjoner av faktorer er representert i like stor grad.
På den menneskelige side har vi en iboende tendens til å bli påvirket av forslag noen gir oss, såkalt bekreftelsesbias. Som ved metoder flest, fordrer derfor klok håndtering at forbrukeren har bevissthet og forståelse for verktøyets styrker og svakheter, samt tilstrekkelig validering, før klinisk bruk.
Veien fremover
De teknologiske fremskrittene bygger på mange års forskning og utvikling. Regjeringens milliardsatsing på KI-forskning understreker viktigheten av å fortsette denne innsatsen.
KI har allerede begynt å endre måten vi leverer helsetjenester på, og potensialet for videre utvikling er stort. Ved å tilgjengeliggjøre medisinske data og utnytte dem mer effektivt, kan KI bidra til både økt kvalitet og redusert karbonavtrykk innen helsesektoren. Og ikke minst: gi innsikt i medisinske sammenhenger som er skjult for det blotte øye.
Kilder:
- Hannisdal, M. H., Goplen, D., Alam, S., Haasz, J., Oltedal, L., Rahman, M. A., Rygh, C. B., Lie, S. A., Lundervold, A., & Chekenya, M. (2023). Feasibility of deep learning-based tumor segmentation for target delineation and response assessment in grade-4 glioma using multi-parametric MRI. Neuro-oncology advances, 5(1), vdad037. https://doi.org/10.1093/noajnl/vdad037
- The Royal Swedish Academy of Sciences. Nobel Prize announcement. Hentet 10. Oktober 2024 fra https://www.nobelprize.org/
- Los Angeles County Museum of Art. (u.å.). The Treachery of Images (This is Not a Pipe) (La trahison des images [Ceci n'est pas une pipe]). Hentet 14. september 2024 fra https://collections.lacma.org/node/239578
- Dill, K. A., & MacCallum, J. L. (2012). The protein-folding problem, 50 years on. Science (New York, N.Y.), 338(6110), 1042–1046. https://doi.org/10.1126/science.1219021
- AlphaFold Protein Structure Database. https://alphafold.ebi.ac.uk/
- Callaway E. (2020). 'It will change everything': DeepMind's AI makes gigantic leap in solving protein structures. Nature, 588(7837), 203–204. https://doi.org/10.1038/d41586-020-03348-4






























